Jest szczepionka na Covid-19 z "95 proc. skutecznością". Dystrybucja na początku 2021 r.!
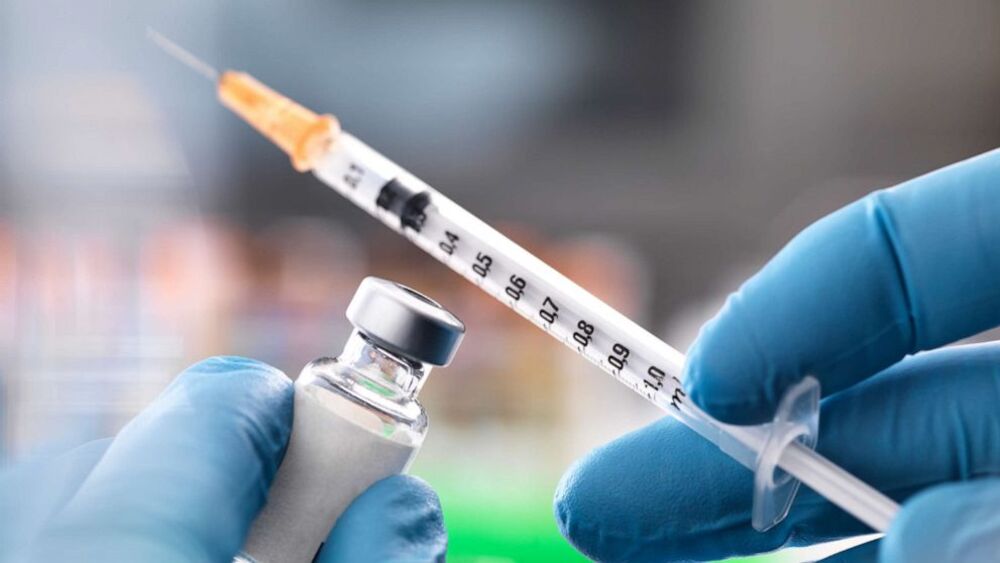
Wczoraj amerykańska firma Moderna podała informację, że wstępne wyniki badań klinicznych szczepionki przeciw koronawirusowi Moderny wykazały skuteczność na poziomie 94,5 proc. Amerykańskie przedsiębiorstwo poinformowało, że nie stwierdzono także znaczących uwag co do bezpieczeństwa.
Jak podaje RMF FM skuteczność szczepionki obliczono na podstawie potwierdzonych dotychczas infekcji koronawirusem wśród uczestników badań klinicznych. Wśród 30 tys. uczestników badań 95 uległo zakażeniu, z czego 90 z nich to osoby, które zamiast szczepionki otrzymały placebo. Jak podała Moderna, 11 z infekcji były ciężkimi przypadkami, a wszystkie z nich dotyczyły grupy kontrolnej. 15 zakażonych osób to seniorzy. Badanie nie wykazało znaczących skutków ubocznych szczepionki, z których większość była "łagodna lub umiarkowana". Najczęstszym efektem ubocznym po pierwszej dawce szczepionki był ból w miejscu wykonania zastrzyku (2,7 proc.), zaś po drugiej - zmęczenie (9,7 proc.), ból mięśni (8,9 proc.), ból stawów (5,2 proc.) i ból głowy (4,5 proc.). Jak podaje firma, objawy te "były generalnie krótkotrwałe". Ostateczna ocena skuteczności może się jeszcze zmienić w miarę trwania badań i wykrywania kolejnych przypadków. Firma planuje złożyć wniosek o pozwolenie na dopuszczenie do użytku w trybie nadzwyczajnym w USA w przeciągu tygodni, ale w pierwszej kolejności otrzymają je tylko osoby szczególnie narażone na infekcję. Według szacunków firmy, szeroka dystrybucja preparatu nastąpi najwcześniej na przełomie I i II kwartału 2021 roku. Co ważne, badania wciąż nie zakończyły się publikacją naukową, wiele wątpliwości - choćby na temat trwałości zapewnianej ochrony - pozostaje, ale powodów do optymizmu jest dużo.
Oznacza to, że Moderna jest drugą zachodnią firmą, która opublikowała wstępne wyniki trzeciej fazy badań klinicznych. Wcześniej zrobiły to firmy BioNTech i Pfizer, które oszacowały skuteczność wspólnej szczepionki na ponad 90 proc. Oba środki to szczepionki nowej generacji mRNA, będące pierwszymi w swoim rodzaju. Obie szczepionki wymagają transportu i przechowywania w bardzo niskich temperaturach - w przypadku preparatu Moderny, jest to -20C. Jak jednak podała firma, szczepionka może być używana do 30 dni po rozmrożeniu przechowywana w lodówce, podczas gdy w przypadku Pfizer/BioNTech okres ten wynosi 5 dni. Szczepionka Moderny była częścią programu amerykańskiego rządu "Operation Warp Speed". W sierpniu wstępną umowę na co najmniej 80 mln dawek preparatu firmy zawarła Unia Europejska.
Informacje o kolejnej szczepionce z pozytywnymi wynikami spowodowały reakcję władz Unii Europejskiej. Przewodnicząca Komisji Europejskiej Ursula von der Leyen wyraziła w poniedziałek nadzieję na szybką finalizację umów z amerykańskim koncernem Moderna ws. zakupu szczepionek na Covid-19.
Jak stwierdziła w poniedziałek komisarz UE ds. zdrowia Stella Kyriakides, negocjacje nadal trwają, ale kontrakt nie został jeszcze sfinalizowany. Komisarz poinformowała, że jeszcze w tym tygodniu podpisana zostanie umowa o dostawie do 300 mln dawek szczepionki opracowanej przez firmy Pfizer i BioNTech, której skuteczność potwierdziły badania. Komisja zamierza też zakupić do 405 mln dawek szczepionki niemieckiej firmy CureVac, która jednak jeszcze nie rozpoczęła ostatniej fazy badań. W poniedziałek z kolei Europejska Agencja Leków poinformowała o rozpoczęciu bieżącej analizy danych z badań szczepionki opracowywanej przez hiszpańską filię Moderny. Jak dotąd UE rozpoczęła negocjacje w sprawie zakupu szczepionek co najmniej z sześcioma producentami: Pfizer/BioNTech, CureVac, Moderną, Sanofi-GSK, Johnson&Johnson oraz AstraZeneca. Szczepionki mają zostać rozdzielone między wszystkie kraje członkowskie według kryterium liczby ludności.
Wyścig związany z powstaniem szczepionki jest zacięty. Informacje o jej powstaniu podała także Rosja. Szczepionka Sputnik V została oficjalnie zarejestrowana w Rosji, ale wciąż trwają jej badania. Bierze w nich udział około 40 tysięcy ochotników, z których 16 tysięcy otrzymało pełną porcję preparatu - dwie dawki w odstępie trzech tygodni. Ponad 20 tysięcy uczestników badania przyjęło na razie pierwszą dawkę. Pod koniec października media zachodnie informowały, że szczepienia w Rosji w ramach badań zostały przerwane z powodu niedostatecznej ilości preparatu. Centrum im. Gamalei zdementowało te doniesienia.
DZ
Źródło: RMF FM


![Dramat w Chełmnie! Kierujący Mitsubishi staranował 6 osób! [VIDEO]](https://www.prawy.pl/thumb/120x68/uploads/images/kierujacy-mitsubishi-1752294676.png)




![Dramat w Chełmnie! Kierujący Mitsubishi staranował 6 osób! [VIDEO]](https://www.prawy.pl/thumb/300x169/uploads/images/kierujacy-mitsubishi-1752294676.png)





